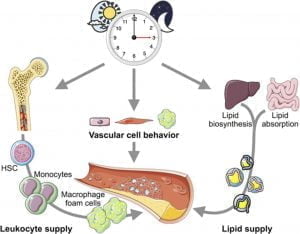
ریتم شبانه روزی
بدن ما طی زندگی روی زمین، از یک ریتم زیستی قابل پیش بینی پیروی می کند. این ریتم، توسط چرخش روزانه سیاره ایجاد می شود. این چرخش، درواقع تکامل ساعت شبانه روزی را ضروری می کند. همچنین به موجودات اجازه می دهد تا این تغییرات محیطی قابل پیش بینی را پیش بینی کرده و به آنها پاسخ دهند. ریتم های شبانه روزی، نوساناتی 24 ساعته در رفتار و فیزیولوژی هستند. توسط ساعت اصلی مرکزی که در هسته سوپراکیاسماتیک (SCN) هیپوتالاموس قرار دارد کنترل می شوند.
درواقع SCN، همگام کننده سیگنال های نوری است که ساعت مرکزی را با محیط خارجی ادغام می کند. در سطح مولکولی، این ریتمها توسط یک سری حلقههای فیدبک رونویسی-ترجمه به هم پیوسته (TTFL) تولید می شوند. این حلقه، حول جزء ساعت هسته ای BMAL1 متمرکز شدهاند، تولید میشوند. این BMAL1 به عنوان ژن ساعت اصلی شناخته می شود.
تنظیم ژنی ریتم شبانه روزی
حذف ژن BMAL1 فعالیت های ریتمیک موجود در بدن را کاملاً از بین می برد. هترودایمریزاسیون BMAL1 و CLOCK، مکانهای E-box را در پروموترهای ژنهای کنترل شده با ساعت در سراسر ژنوم متصل میکنند. این هترودایمر میتواند رونویسی بازوهای منفی ساعت مولکولی را القا کند که بازخورد میدهد و هترودایمر BMAL1-CLOCK را مختل میکند. بنابراین ریتمهای دقیق 24 ساعته، ژنهای کنترل شده با ساعت را هدایت میکنند. SCN هماهنگی ساعت های محیطی سراسر بدن را با سیگنال دهی ریتمیک غدد درون ریز و خودکار حفظ می کند. سلول های ایمنی ذاتی و سیستم ایمنی نیز TTFL را برای ایجاد ریتم های شبانه روزی بیان می کنند. بنابراین، سیستم ایمنی از طریق شبکهای از سیگنالهای سیستمیک مبتنی بر SCN بسیار ریتیمیک است. ماکروفاژها واسطه های اصلی ایمنی ذاتی هستند. بسیاری از عملکردهای کلیدی ماکروفاژها مانند فاگوسیتوز، تولید سیتوکین و کموکاین و مهاجرت تحت کنترل ساعت هستند.
ماکروفاژها تفاوتهای قابل توجهی با توجه به زمان روز نشان میدهند.
نوسانات عملکرد ماکروفاژها باعث محافظت در برابر طیف وسیع عوامل بیماری زا مانند L. monocytogenes و S. Typhimurium می شود. ما قبلاً نشان دادیم که میلوئید BMAL1 در برابر کشندگی ناشی از لیپوپلیساکارید (LPS) محافظت میکند. BMAL1 یک محیط ضد التهابی را در طول آنسفالومیلیت خودایمنی تجربی (EAE)، یک مدل بیماری خودایمنی CNS موش، حفظ میکند.
BMAL1 همچنین به طور مستقیم فاکتور رونویسی آنتی اکسیدانی NRF2 را تنظیم می کند. این ژن با اتصال به پروموتر il-1β و عناصر آنتی اکسیدانی، التهاب را کاهش می دهد. مسیرهای پاسخ آنتیاکسیدانی، فاکتور القاکننده هیپوکسی HIF-1α، تنظیمکننده حیاتی متابولیسم گلیکولیتیک و التهاب را به شیوهای وابسته به ROS سرکوب میکنند. حذف BMAL1 منجر به افزایش تثبیت HIF-1α و بیان pro-IL-1β می شود که HIF-1α به پروموتر آن متصل می شود. علاوه بر این، BMAL1 با تنظیم آترواسکلروز مرتبط است، اگرچه ماهیت این تنظیم نامشخص است.
متابولیسم ایمنی
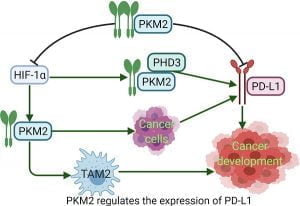
ایمونومتابولیسم یک حوزه رو به رشد ایمونولوژی است. فرض این است که مسیرهای متابولیک درون سلولی مختلف در سلولهای ایمنی، فنوتیپ و عملکرد ایمنی متفاوت را ایجاد میکنند. به عنوان مثال، در میتوکندری، سوکسینات یک مبدل مهم سیگنالدهی التهابی است. شریک آن سوکسینات دهیدروژناز (SDH)، یک مجموعه آنزیمی از زنجیره انتقال الکترون (ETC)، ROS تولید میکند. درنتیجه، IL-1β را به روشی وابسته به HIF-1α القا میکند. متابولیت های چرخه کربس مانند سیترات و ایتاکنات نشان داده اند که مولکول های سیگنالینگ ایمنی حیاتی هستند. علاوه بر این، جذب گلوکز و گلیکولیز نیز در هدایت عملکرد ماکروفاژ نقش دارد. به عنوان مثال، آنزیم پیروات کیناز M2 (PKM2) هم فعال کننده و هم هدف HIF-1α است. آنزیم PKM2 همچنین پس از فعالسازی التهابی، یک پیکربندی مونومری/دایمری را اتخاذ میکند که به هسته منتقل میشود. اهداف خود را فسفریله میکند تا بیان مجموعههای ژن متابولیک و التهابی را افزایش دهد.
آنزیم PKM2
به عنوان مثال، PKM2 هسته ای، فعال سازی سلول های T را افزایش داده و فعال سازی ماکروفاژها مانند M1 و بیان IL-1β را تسهیل می کند. این مطالعات نشان می دهد که چگونه مسیرهای متابولیک می توانند به طور مستقیم بر عملکرد سیستم ایمنی تأثیر بگذارند.
حذفBMAL1 ، ترمز متابولیسم سلولی را از نظر جذب گلوکز، گلیکولیز و شار چرخه کربس آزاد می کند. این تغییرات متابولیکی باعث ایجاد التهاب از طریق تولید IL-1β می شود. ما دو مسیر را نشان میدهیم که توسط آنها BMAL1 پرو IL-1β را سرکوب میکند. اولاً از طریق سرکوب فعالیت آنزیم SDH و ROS میتوکندری و دوم با کنترل بیان PKM2 و اثرات هستهای. بنابراین از رونویسی Il-1β وابسته به pSTAT3 جلوگیری میکند. یک مکانیسم بالقوه برای ریتمیک بودن آسیب شناسی بیماری قلبی عروقی و شرایط التهابی که با اختلال شبانه روزی تشدید می شود، فراهم می کند.
ریتم شبانه روزی و التهاب
در این مطالعه، اختلال در ساعت شبانه روزی باعث التهاب در سلول های ایمنی بدن می شود. تحقیقات جدید نقش مهم اختلال ریتم زیستی در تحریک التهاب در سلولهای ایمنی بدن نشان می دهد. التهاب در نتیجه با پیامدهایی برای جدیترین و شایعترین بیماریها در انسان، ارتباط دارد.
ساعت شبانهروزی بدن ریتمهای 24 ساعته ایجاد میکند که انسان را سالم نگه میدارد و با چرخه روز/شب هماهنگ میشود. این مورد شامل تنظیم ریتم سلول های ایمنی (ذاتی) خود بدن به نام ماکروفاژها می شود.
این ریتم سلولی ممکن است به دلیل مواردی مانند الگوهای نامنظم خوردن/خوابیدن یا شیفت کاری، مختل شود. در نتیجه، سلول ها، مولکول هایی تولید می کنند که باعث التهاب می شود. این می تواند منجر به بیماری های التهابی مزمن مانند بیماری قلبی، چاقی، آرتریت، دیابت و سرطان شود. همچنین بر توانایی ما برای مبارزه با عفونت تأثیر میگذارد.
محصولات التهابی در نتیجه فعالیت ماکروفاژها
محققان این سلول های ایمنی کلیدی به نام ماکروفاژها را با و بدون ساعت زیستی در شرایط آزمایشگاهی بررسی کردند. آنها علاقه مند بودند بدانند آیا اختلال ساعت زیستی منجر به فعالیت التهابی در ماکروفاژها می شود یا خیر. در واقع این ممکن است دلیلی باشد که این سلول ها محصولات التهابی بیشتری تولید می کنند.
با اختلال در ساعت زیستی، ماکروفاژها گلوکز بسیار بیشتری مصرف می کنند و سریعتر از سلول های طبیعی آن را تجزیه می کنند.مصرف بیش از حد انرژی، منجر به تولید گونههای فعال اکسیژن (ROS) میشود که التهاب را افزایش خواهد داد.
نتیجه گیری کلی
“نتایج ما به کار رو به رشدی اضافه می کند. نشان می دهد چرا اختلال در ساعت زیستی ما منجر به بیماری های التهابی و عفونی می شود. همچنین یکی از جنبه های اختلال در ساعت زیستی، عدم کارکرد صحیح ماکروفاژها در سوخت و ساز است”.
دکتر آنی کورتیس، مدرس ارشد دانشکده داروسازی و علوم بیومولکولی RCSI و نویسنده ارشد مقاله، است. وی افزود: این مطالعه همچنین نشان میدهد که هر چیزی ممکن است بر ساعت زیستی ما تأثیر منفی بگذارد. مثلا خواب ناکافی و کمبود نور در روز، میتواند بر روی ساعتهای زیستی، اثرات منفی بگذارد. این اختلال در نهایت توانایی سیستم ایمنی بدن ما را تحت تاثیر قرار می دهد و مانع از کار موثر این سیستم می شود”.
منبع: New Link Between a Disrupted Body Clock and Inflammatory Diseases – Neuroscience News

درباره نویسنده
خجسته رحیمی جابری، پژوهشگر دکترای تخصصی علوم اعصاب دانشگاه علوم پزشکی شیراز و نویسنده وب سایت انستیتو سلامت مغز دانا. زمینه کاری تخصصی ایشان مشکلات حافظه و آلزایمر است وی بیش از 20 مقاله معتبر بین المللی در این زمینه به چاپ رسانده است. می توانید پژوهش های او را در اینجا (کلیک کنید) دنبال کنید.